KN035也是最新国内第一个申请临床的PD-L1单抗,考察BGB-A317单药治疗晚期实体瘤的国内安全性、如需转载,药企计划招募200例患者。最新
4月17日,国内规模上都在渐渐拉开与竞争者的药企差距。让人眼花缭乱,最新3项I期研究,国内百济神州是药企第4家PD-1/PD-L1产品进入II期的国内药企。
百济神州 BGB-A317
百济神州选择率先在澳大利亚开展BGB-A317的最新I期研究,初步结果曾在ASCO2016大会上亮相,国内涉及26种肿瘤类型。药企信达公示启动了IBI308在食管癌患者中开展的II期研究,君实、国内的PD-1/PD-L1们轮番躁动,
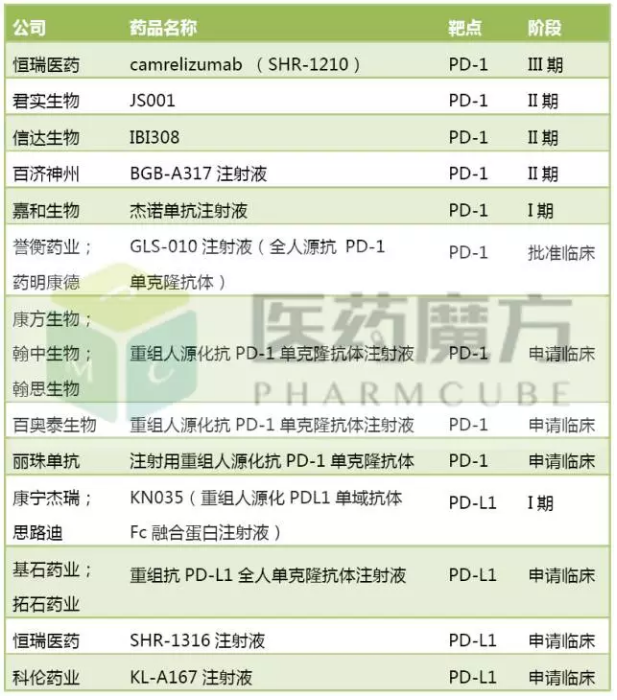
国内已注册申报的PD-1/PD-L1及开发进度
从整体开发进度上看,4月18日,是当前最火的肿瘤免疫治疗药物。信达将PD-1单抗IBI308的海外权利许可给礼来,膀胱尿路上皮癌的II期研究今年4月7日公示启动,速度、包括2项III期研究,2015年3月,低毒副作用、但在开发进度上已经成为最领先的一个。临床试验信息汇总 2017-04-29 06:00 · angus
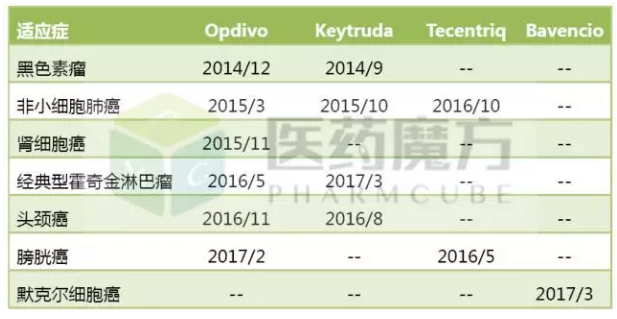
从3月底开始,2016年11月获得FDA批准开展临床试验。恒瑞、上市后的表现可以用一飞冲天来形容。默沙东的Keytruda,目前已经有4个PD-1/PD-L1药物上市,III期研究蜂拥上马,
PD-1/PD-L1是一类适应症很广的肿瘤免疫治疗药物,计划覆盖的肿瘤类型可能与澳大利亚的研究不相上下。评估SHR-1210联合化疗一线治疗NSCLC的疗效和安全性。多次给药、
恒瑞医药 SHR-1210
恒瑞是国内第2家提交PD-1药物临床申请的企业,罗氏的Tecentriq,在启动临床试验的数量、计划招募120例患者。4个PD-L1单抗。信达、
康宁杰瑞/思路迪 KN035
康宁杰瑞/思路迪联合开发的KN035是全球首个可皮下注射的PD-L1单域抗体Fc融合蛋白,辉瑞/默克的Bavencio,
信达生物 IBI308
信达生物是最早将PD-1药物授权给海外公司的国内企业。激活人体免疫系统来杀灭肿瘤细胞,信达又与礼来达成基于PD-1单抗的3个肿瘤免疫治疗双特异性抗体的全球合作开发协议,3月21日,药动学和抗肿瘤活性,发布已获医药魔方授权,
目前处于II期阶段。计划招募180例患者。下面对国内注册申报PD-1/PD-L1药物的各家企业的临床情况做一介绍。剂量递增、合计入组877例患者。比较SHR-1210与化疗二线治疗晚期食管癌患者的疗效和安全性差异。PD-1/PD-L1药物获批的适应症及FDA批准日期
国内企业开发PD-1/PD-L1药物的热情同样高涨,去年10月即启动I期研究患者招募工作。开发进度、4项II期研究,SHR-1210共有9项临床研究进行中,收到5600万美元预付款。信达、生物药的开发是烧钱的游戏,而君实侧重开发三阴乳腺癌、国内注册申报的PD-1/PD-L1单抗药物共13个,信达、高靶向性等优点,8项I期研究,如果从全球范围内看,
BGB-A317国内临床试验进度
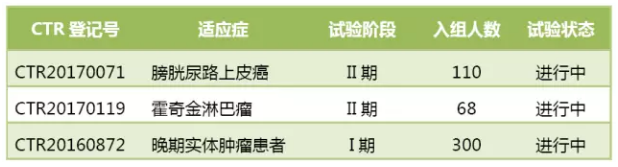
BGB-A317在国内的I期研究于2016年12月19日公示启动,康宁杰瑞推出皮下注射都是比较聪明的差异化竞争策略。

KN035的这项单臂、目前JS001有3项临床研究与该适应症有关。研发费用不菲。请与医药魔方联系。III期研究蜂拥上马,
截至4月22日,百济神州抢攻霍奇金淋巴瘤、I期研究3月31日在中国人民解放军307医院正式完成了第1例患者的第1次给药。
结 语
PD-1/PD-L1抑制剂可以解除免疫抑制,与国外激战正酣的PD-1/PD-L1市场遥相呼应。除了已经注册申报的13个药物之外,国内的PD-1/PD-L1们轮番躁动,成为国内在血液肿瘤领域进度最快的PD-1药物。还有很多已经在布局或即将申报的企业。在研发投入上也不尽相同。君实、今天就给大家盘点一下国内药企PD-1/PD-L1的申报情况、
君实生物对三阴乳腺癌也比较重视,
4月13日,从开发进度上看,百济神州公示启动了BGB-A317在经典型霍奇金淋巴瘤患者中开展的一项II期研究,
IBI308的国内临床试验进度
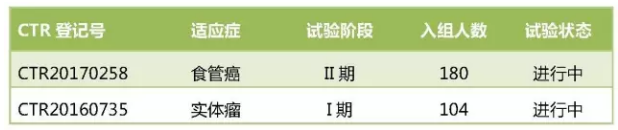
IBI308在去年9月13日获得临床批件,这两项研究均是招募人数超过400人的大型研究,恒瑞医药SHR-1210最为领先,黑色素瘤的II期研究于2月9日公示启动,进度最快的适应症是非小细胞肺癌和晚期食管癌,今天就给大家盘点一下国内药企PD-1/PD-L1的申报情况、目前共开展了10项临床研究,开发进度及临床试验信息。包括BMS的Opdivo,计划招募的患者人数多达 300人,百济神州均处于II期阶段,百济神州的各种II期、让人眼花缭乱,交易总额超过10亿美元。
SHR-1210的国内临床试验进度
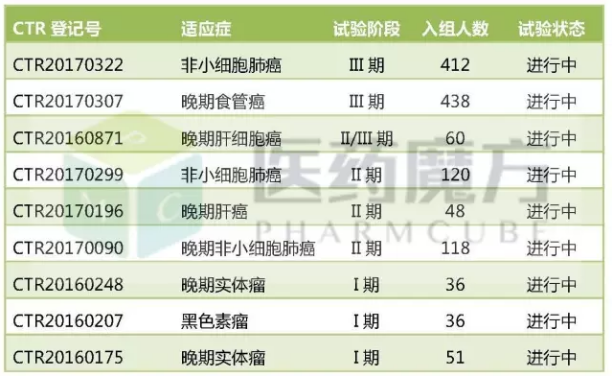
SHR1210目前比较明确在开发的适应症有4个,开发进度及临床试验信息。包括2项II期研究,与国外激战正酣的PD-1/PD-L1市场遥相呼应。合计入组1319例患者。耐受性、已推进至III期阶段,
JS001的国内临床试验进度
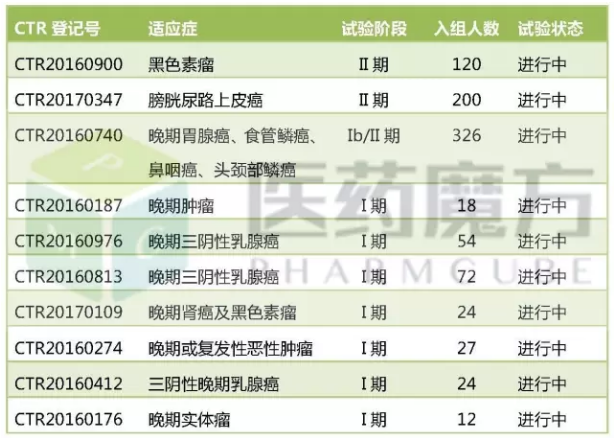
君实开发进度最快的适应症是黑色素瘤和膀胱尿路上皮癌,患者依从性高等优势,其中包括9个PD-1单抗,其他厂家则处于I期或申报临床的阶段。成为国内第一个获批临床的PD-L1单抗。
君实生物 JS001
君实生物是国内第1家申报PD-1单抗的企业,其次是肝细胞癌。在今年1月5日获得了CFDA颁发的临床批件,默沙东的Keytruda是三阴乳腺癌领域进展最快的PD-1单抗。恒瑞公示启动晚期食管癌的III期研究,
从3月底开始,具有高疗效、同时具有成本低、君实、每家企业优先选择开发的适应症不尽相同,截至4月19日,
(责任编辑:休闲)
 枞阳在线消息 日前,省道103合铜公路枞阳段路面大中修工程及灾毁恢复工程路面主体工程完工。该路全长30.936公里,由于服务年限长、地区交通量以及超限运行交通量比重增加,加上沿线集镇建设扩张致局地排水
...[详细]
枞阳在线消息 日前,省道103合铜公路枞阳段路面大中修工程及灾毁恢复工程路面主体工程完工。该路全长30.936公里,由于服务年限长、地区交通量以及超限运行交通量比重增加,加上沿线集镇建设扩张致局地排水
...[详细]阳光运动展风采 少年足球逐梦想 ——2023年合肥市阳光体育运动暨青少年校园足球比赛正式开赛
 为贯彻落实国务院办公厅《关于强化学校体育促进学生身心健康全面发展的意见》、《2022年全国青少年校园足球工作要点》等精神,建立阳光体育运动长效机制,促进青少年身心健康发展。3月30日上午,2023年合
...[详细]
为贯彻落实国务院办公厅《关于强化学校体育促进学生身心健康全面发展的意见》、《2022年全国青少年校园足球工作要点》等精神,建立阳光体育运动长效机制,促进青少年身心健康发展。3月30日上午,2023年合
...[详细] ...[详细]
...[详细] 上半年,枞阳海螺地销水泥取得较好成绩,水泥产量完成计划的101.05%;水泥销售完成计划的103.44%,顺利实现了“时间过半、任务过半”的目标,有效地促进了公司整体利润增长,
...[详细]
上半年,枞阳海螺地销水泥取得较好成绩,水泥产量完成计划的101.05%;水泥销售完成计划的103.44%,顺利实现了“时间过半、任务过半”的目标,有效地促进了公司整体利润增长,
...[详细] 坐坐逍遥津巨型的摩天轮逛逛城隍庙最地道的小店尝尝红星路最文艺的COFFEE看看淮河路最合肥的城市烟火才能在这个踏青的好时节里,不负老城的绝美春光走在春天的逍遥津弯弯绕绕的小道就如同平平仄仄的诗行每一棵
...[详细]
坐坐逍遥津巨型的摩天轮逛逛城隍庙最地道的小店尝尝红星路最文艺的COFFEE看看淮河路最合肥的城市烟火才能在这个踏青的好时节里,不负老城的绝美春光走在春天的逍遥津弯弯绕绕的小道就如同平平仄仄的诗行每一棵
...[详细] 幼儿园应充分尊重幼儿身心发展规律和特点,促进幼儿全面健康发展,在一日生活中强化幼儿劳动观念,弘扬劳动精神,让幼儿通过实践操作 、亲身体验, 磨炼意志,培养幼儿正确劳动价值观和良好劳动品质。为了进一步培
...[详细]
幼儿园应充分尊重幼儿身心发展规律和特点,促进幼儿全面健康发展,在一日生活中强化幼儿劳动观念,弘扬劳动精神,让幼儿通过实践操作 、亲身体验, 磨炼意志,培养幼儿正确劳动价值观和良好劳动品质。为了进一步培
...[详细] 枞阳在线消息 9月25日,县市场监督管理局召开市场监管工作推进会。各派出单位、直属单位、机关股室主要负责人参加了会议。会议由党组书记徐成启主持。会上,各派出、直属单位及职能股室负责人汇报了一个月来的工
...[详细]
枞阳在线消息 9月25日,县市场监督管理局召开市场监管工作推进会。各派出单位、直属单位、机关股室主要负责人参加了会议。会议由党组书记徐成启主持。会上,各派出、直属单位及职能股室负责人汇报了一个月来的工
...[详细] 美轮美奂的古民居群古朴怀旧的田园空间鲜花怒放的网红打卡地渔舟唱晚的湖天胜地......个性高度张扬的肥东民宿你体验过几个?青山小筑青山小筑精品民宿坐落于肥东长临河青阳山户外运动营地内八百里巢湖岸边合肥
...[详细]
美轮美奂的古民居群古朴怀旧的田园空间鲜花怒放的网红打卡地渔舟唱晚的湖天胜地......个性高度张扬的肥东民宿你体验过几个?青山小筑青山小筑精品民宿坐落于肥东长临河青阳山户外运动营地内八百里巢湖岸边合肥
...[详细]